

何川
1Nature:m6A通过YTHDF 1促进海(hǎi)马依赖性(xìng)学习和记忆

N6-甲(jiǎ)基腺(xiàn)苷(gān)(m6A)是哺乳动物信使RNA上最(zuì)普遍的(de)内部RNA修饰,通过m6A特异性结合蛋白调控修饰转录的目(mù)的(de)和(hé)功能。在神经系统中,m6A数量丰富,功能多样。在之前的研(yán)究中人(rén)们得知,m6A标(biāo)记不同生理过程中协(xié)调降解的mRNAs组(zǔ),但是,在体内m 6A和mRNA翻译的相关(guān)性仍(réng)然是未知(zhī)的。
本文中(zhōng),研究人(rén)员(yuán)发(fā)现,通过结合蛋白YTHDF 1,m6A促(cù)进成年小鼠海马体神经元刺激反(fǎn)应的转录的蛋白翻(fān)译,从(cóng)而促进学习和记忆。敲除Ythdf 1基因的小鼠显示学习和记忆缺陷以及海(hǎi)马突触传递受(shòu)损。YTHDF 1在成年Ythdf 1-敲除小鼠海马体中的再(zài)表达,可以修复行为和突触缺陷,而(ér)海马体(tǐ)上(shàng)特(tè)异性精(jīng)确敲除(chú)Ythdf 1或METTL 3(其编码了m6A甲基转(zhuǎn)移酶复合物中的(de)催化组分)则(zé)重现为海马体缺(quē)乏症(zhèng)。海马体上mRNAs的YTHDF 1结合位点(diǎn)和m6A 结(jié)合位(wèi)点确定了关键的神经元(yuán)基因。新生蛋白(bái)标记和海(hǎi)马体(tǐ)神经元系绳(shéng)报告试验表(biǎo)明(míng),YTHDF 1以神经元刺激(jī)依赖(lài)的方式促进蛋白质合(hé)成。总之,YTHDF 1有助于翻译m6A-甲基(jī)化神经元mRNAs对神经元刺激(jī)的反应,这一(yī)过程有助于学习和(hé)记忆。
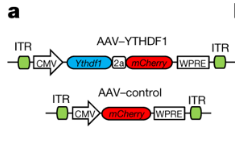
高表达YTHDF1(AAV-YTHDF 1)和对(duì)照(AAV-对照)的AAV结构(gòu)示意图。
研(yán)究证明(míng),YTHDF 1的缺失(shī)损(sǔn)害了(le)海马体突触的基础(chǔ)传递和(hé)LTP。YTHDF 1的存在可以(yǐ)加速(sù)新的蛋白质合成,这是(shì)突触可(kě)塑性(xìng)和记忆(yì)形成(chéng)的长期变化所必需(xū)的;Ythdf 1-KO小鼠,刺激依赖(lài)的蛋白质合成减弱,导(dǎo)致突触强化(huà)效(xiào)率较低,达到记忆形(xíng)成阈值的可能性较低。m6A对(duì)翻译的促进作用可能是通过刺激诱(yòu)导(dǎo),如(rú)文中对YTHDF 1的作用,这可能代(dài)表RNA甲基化依赖的翻译调节(jiē)的一个重要(yào)方面。
原文链(liàn)接:
https://www.nature.com/articles/s41586-018-0666-1
2Cell Research:A dynamic N6-methyladenosinemethylome regulates intrinsic and acquired resistance to tyrosine kinaseinhibitors

白血(xuè)病是一种侵袭性恶(è)性肿瘤,通(tōng)常与(yǔ)激活(huó)受体(tǐ)酪氨(ān)酸激酶(RTKs)突变有关,包(bāo)括BCR / ABL,KIT和(hé)FLT3等(děng)。许多针对这些突变的酪氨(ān)酸激酶抑(yì)制剂(jì)(TKIs)已进(jìn)入临床,但迅速获(huò)得对(duì)TKIs的抵抗是(shì)成功治疗白(bái)血病的主要障(zhàng)碍。最(zuì)常被引用的机制是获得性药物抗性突变,其损害药(yào)物结合或绕过(guò)抑(yì)制的RTK信号传导。然而,这不足以揭(jiē)示(shì)药物(wù)暴露(lù)后TKI耐药性的出现相对(duì)迅速的情况(kuàng)。在“药物假(jiǎ)期”之后,抗性表型是可逆的。许多具有抗性的患者也(yě)仅表达天然激酶(例如(rú),BCR / ABL)或已经激活平行途(tú)径,涉及癌基因的(de)过度简化(例如,BCL-2,BCL-6,AXL和MET)。
事实上(shàng),最近的研究结果已经将(jiāng)获得性TKI耐(nài)药性与肿瘤内的细胞异质性和表观基因组构型(xíng)的动态(tài)变异联系起来(lái)。据推测,异(yì)质(zhì)性肿瘤细胞群中不同的表观遗(yí)传模式可以(yǐ)在细胞(bāo)命运决(jué)定基(jī)因的(de)表达中产生多样性(xìng)。通(tōng)过药物(wù)选择可以迅速发展(zhǎn)。然而,TKI抗性中(zhōng)关键表观遗传事件的描述远未完(wán)成。
N6-甲基(jī)腺苷(gān)(m6A)是哺乳(rǔ)动物mRNA最常见的上皮转录组修饰.14,15,16它(tā)由甲基转移酶复(fù)合(hé)物(wù)(如METTL3-METTL14)安装(zhuāng),可被(bèi)去甲基化酶清除(如FTO和(hé)ALKBH5)。虽然任何特定m6A残基的(de)确切作用(yòng)尚不(bú)清楚,但(dàn)21个(gè)丰富(fù)的证据(jù)支(zhī)持m6A甲基化,一(yī)般来说,严格调节mRNA稳定性,剪接和/或蛋白质翻译,从而影响基因(yīn)表达。一致地,沉默m6A甲基转移酶(méi)(例如,IME4,METTL3的酵母直向同源物(wù))或FTO的敲低(dī)改变m6A丰度(dù),重新(xīn)建模基因(yīn)表达谱(pǔ)和(hé)/或转录(lù)物的可变(biàn)剪接模式。
尽管最近关于角色的(de)工作m6A在各种生物学过程中的作(zuò)用,m6A甲基化(huà)是否以及(jí)如何调节TKI选择下的细胞命运决(jué)定(dìng)仍然(rán)未知。我(wǒ)们假设,暴(bào)露于TKI后,m6A甲基化的可逆性质使得携带m6A位点的一组增殖(zhí)/抗凋亡癌(ái)基因上调,从而帮(bāng)助细胞亚群逃避TKI介导的杀伤。为了测试这一点,我们模拟并表征(zhēng)了不(bú)同白血病模(mó)型(xíng)中的TKI抗性,并直接(jiē)在白血(xuè)病细胞的(de)转录组中定位m6A。我们的研究结果表明,内在和诱(yòu)导型FTO-m6A轴作为表(biǎo)征白血病细胞异质性的新标记,以及白(bái)血病细胞(bāo)产生TKI抗性(xìng)表型的广泛(fàn)防御机制。我们的发现确定了针对FTO-m6A轴预防(fáng)/根除获得(dé)性(xìng)TKI耐药性的可(kě)行(háng)性(xìng)。
研究人员的(de)研究结果(guǒ)显示在酪氨(ān)酸激酶抑制剂(TKI)治疗期(qī)间开发抗性表型取(qǔ)决(jué)于白血病细胞(bāo)中FTO过表达导(dǎo)致的m6A减少。这种失调(diào)的FTO-m6A轴预(yù)先存在于幼稚细胞群中,这些细胞群具(jù)有遗(yí)传同质性,并且(qiě)响(xiǎng)应TKI处理是可诱导(dǎo)/可(kě)逆的。具有mRNAm6A低甲(jiǎ)基化和FTO上调的细胞在小鼠中表现(xiàn)出更高的TKI耐受性和更(gèng)高的生长速(sù)率。通过FTO失活的m6A甲基化(huà)的遗(yí)传或(huò)药理学恢复(fù)使得对TKI敏感的抗性细胞。
从机制上讲,FTO依赖性m6A去甲基化增强了携带m6A的增(zēng)殖(zhí)/存(cún)活转录物的mRNA稳定性,并随后(hòu)导致蛋白质合成增加。我(wǒ)们的研究结果确定了(le)m6A甲基化在调(diào)节细胞命(mìng)运决定中(zhōng)的新功能,并证(zhèng)明动态m6A甲基化组是可逆TKI耐受状态的额外表(biǎo)观遗传驱动因(yīn)子,为癌症中的耐(nài)药性提供了(le)机制典型范(fàn)例。
3Cell:m6A可以控制哺乳动物的皮质神经元(yuán)的发生

由Mett13 / Mett14甲基(jī)转(zhuǎn)移酶复合物催化产生的N6-甲基腺苷(m6A)是最普遍的mRNA内部修饰(shì)。 m6A是否调节哺乳动物的大脑(nǎo)发育是未知(zhī)的。在这里,我们显(xiǎn)示胚(pēi)胎(tāi)小鼠脑(nǎo)中Mettl14敲(qiāo)除下,m6A缺失,延长了神经胶质细(xì)胞的细(xì)胞(bāo)周(zhōu)期,并(bìng)将皮质(zhì)神经发(fā)生(shēng)延(yán)伸到出生后阶段;通过(guò)Mettl3敲除,也得到了类(lèi)似的(de)现象。胚胎(tāi)小鼠皮层的m6A测序(xù)显示,m6A主要富集在(zài)转录因子,神经发生(shēng),细胞周期和神(shén)经元分(fèn)化的(de)mRNA中,m6A标记(jì)促进其衰老。进(jìn)一步的分析发现皮质(zhì)神经干细胞中(zhōng)以前未被认(rèn)可的转录模式中,m6A信号也(yě)调(diào)节前脑(nǎo)组织中的人(rén)皮质神经发生。小鼠与人(rén)类皮质神经发(fā)生之间的m6A-mRNA全基因组的比较,揭示了人(rén)特(tè)异性m6A标记(jì)的(de)转(zhuǎn)录本与(yǔ)脑障碍风(fēng)险基(jī)因相关(guān)。
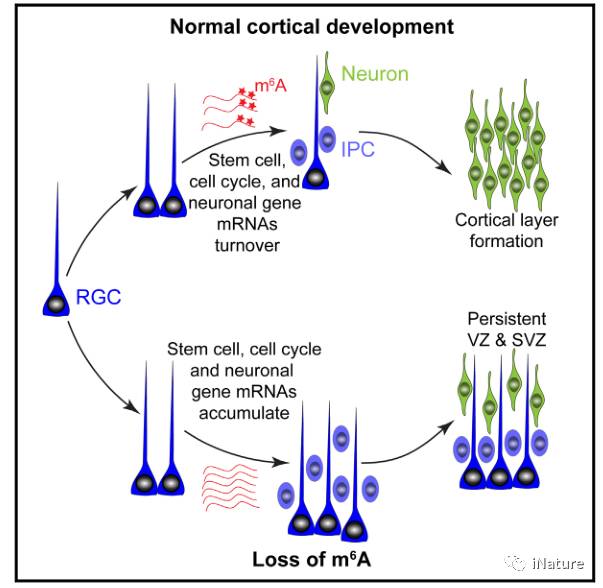
亮点(diǎn)
m 6 A缺失,导(dǎo)致(zhì)皮质神经原始细胞(bāo)的(de)细胞周期延长;
经过比较小(xiǎo)鼠及人(rén)类的m 6 A图谱,呈现出保守及(jí)独特性;
m 6 A促进标记的神(shén)经发生相关(guān)的(de)转录本被延迟降解;
转录本的提前印记对于神经元的(de)发生是必需的。
4Molecular Cell :FTO在细胞核和细胞质中介导的(de)差异m6A,m6Am和(hé)m1A去(qù)甲基化

已经提出脂肪(fáng)量和肥(féi)胖相关蛋白(FTO)通过全(quán)基因组(zǔ)关联研究(GWAS)与人类肥胖相关联。已显示FTO的遗传变异与食物摄入增加(jiā)有(yǒu)关,而FTO中的功能丧失突变导致严重的(de)生长迟缓和CNS缺陷。
由于这(zhè)些有(yǒu)趣的(de)表型,已经广泛(fàn)致力于鉴定(dìng)底物(wù)和理解(jiě)FTO的生物学功能。FTO被鉴定为(wéi)第一种RNA去(qù)甲基化酶(méi),其在体外和细胞中催化mRNA中N6-甲基腺苷(m6A)甲基化的逆转。 m6A是哺乳(rǔ)动物mRNA中最丰(fēng)富的(de)内部修(xiū)饰。已知(zhī)m6Am的m6A部分是FTO的(de)体外(wài)底物(wù),最近的研究表明m6Am通过阻止(zhǐ)DCP2介导的脱帽(mào)和microRNA介导的(de)mRNA降解来稳定mRNA。然而,FTO去(qù)除m6Am的功能相关(guān)性尚未得到充分探(tàn)索。
在(zài)该项研(yán)究(jiū)组中,何川研究组证实(shí)FTO可(kě)以从纯化的多腺苷酸化RNA中有效(xiào)地去甲基化m6A和(hé)m6Am。何川研(yán)究组发现细胞核和细胞质中(zhōng)的FTO定位在细胞类型之间变化,并且FTO在细胞(bāo)核和细胞质中具(jù)有不同的底(dǐ)物库。何川研究组进一(yī)步鉴定(dìng)了FTO的其他RNA底(dǐ)物,包括tRNA中的N1-甲基腺苷(m1A),U6 RNA中的m6A,以及小核RNA(snRNA)中的(de)内部和帽(mào)m6Am。该(gāi)研究提供(gòng)了迄今为止FTO介导的(de)RNA去甲基化的最全面的景观。它揭示了由FTO介导的核与(yǔ)细(xì)胞质去甲基化所赋予的先前未被(bèi)认可的空间调节,其对靶RNA发挥不同(tóng)的作用。
5Nature cell biology:m6A mRNA甲基(jī)化是子宫内膜(mó)癌的致癌(ái)机制

N6-甲(jiǎ)基腺苷(m6A)是人类最普遍的信(xìn)使(shǐ)RNA修(xiū)饰形式。这种修改是(shì)可逆的,其生物学效应主要是(shì)通过“写入”、“橡皮”和(hé)“读取”蛋白(bái)来介导的。所(suǒ)谓的“写入”复合物(wù),核心部分(fèn)为METTL3–METTL14 m6A甲基转移酶(méi),还包括其他(tā)调控因子亚单元(yuán),作用(yòng)是催化m6mRNA甲基化。至少有两种橡皮擦(cā)酶(méi)FTO和ALKBH 5介(jiè)导了甲基化的逆反(fǎn)应。m6甲(jiǎ)基化的转录(lù)被读取器蛋(dàn)白质锁识别(bié),该蛋白可以调(diào)节mRNA前处理、翻译和(hé)退化。在哺乳动物中,m6A依赖的mRNA调节(jiē)是必不(bú)可少(shǎo)的。m6A甲基化的(de)缺陷影响很多的(de)生(shēng)物过程(chéng)。特别的是(shì),m6A mRNA甲基化通(tōng)过影(yǐng)响(xiǎng)细(xì)胞分化过程(chéng)中mRNA的转换而调节干细胞的自我更新和分(fèn)化,并在胚胎发育过程(chéng)中对转录组的转换起重要作(zuò)用。与这些作用一(yī)致,m6A mRNA甲基化是一种影响多(duō)种癌症发生和发(fā)展的途径。
m6mRNA甲基化对(duì)干(gàn)细胞和癌细胞生长和增殖(zhí)有着重(chóng)要影响(xiǎng)。不过,m6A甲基化如(rú)何影响(xiǎng)细胞(bāo)生长,哪些基础(chǔ)途(tú)径(jìng)和机制介导(dǎo)这些变化仍未完全阐明。本文研究子宫内膜癌中的这(zhè)个问题,其中(zhōng)测序研究发现了m6A甲(jiǎ)基转移酶亚(yà)基(jī)METTL 14的频繁突(tū)变(biàn)。研究(jiū)人员发现与对应的正常子宫(gōng)内膜相比,约有70%的(de)子宫内膜(mó)肿(zhǒng)瘤细(xì)胞中m6A甲基化有减少的趋势(shì)。这些(xiē)减少的m6A甲基化可能是由METTL 14的突变或降低METTL 3甲基转移酶的(de)表达。通过METTL 14突变或METTL 3下调,降低m6A mRNA在子宫(gōng)内(nèi)膜癌细胞(bāo)中的水(shuǐ)平,可促进体外和活体细胞增殖和致瘤(liú)性(xìng)。子宫(gōng)内膜(mó)癌(ái)患者(zhě)肿瘤和细(xì)胞(bāo)系的m6A -seq特征显示m6A mRNA甲基化可以通(tōng)过改变影响AKT信号通路的关键酶(méi)的表达来促进(jìn)细胞(bāo)增殖。抑制AKT活(huó)化可以(yǐ)逆转m6A甲基化(huà)减少引起(qǐ)的增殖增加。这些结果共同表明了(le)m6A mRNA甲(jiǎ)基化为子(zǐ)宫内膜癌的致癌(ái)机制,m6A甲基化可以作为(wéi)AKT信号(hào)调节(jiē)因子。
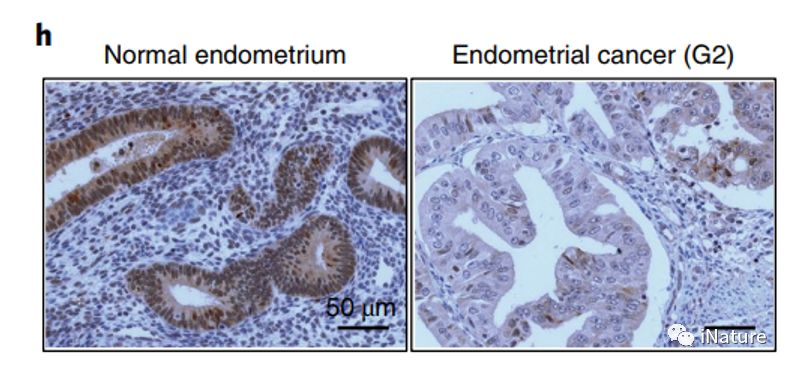 正常子宫内膜(左)和(hé)子宫内膜癌(右(yòu))
正常子宫内膜(左)和(hé)子宫内膜癌(右(yòu))
这些(xiē)发现可能(néng)适用(yòng)于子宫内膜癌以外由AKT信(xìn)号增强所(suǒ)导致的其(qí)他癌症。其(qí)他类型(xíng)可以通过AKT激(jī)活的肿(zhǒng)瘤(liú)可(kě)以利用异(yì)常的(de)RNA甲(jiǎ)基(jī)化来获得(dé)生存和生长优(yōu)势。事实上,也(yě)有其(qí)他研(yán)究观察到(dào)干(gàn)细(xì)胞和(hé)癌细(xì)胞(bāo)的增殖随着m6A甲基化的减(jiǎn)少而增加。当这篇论文被审查时,据报道,m6A甲基(jī)化会(huì)影响AML中AKT的活性,以及肾细胞癌(ái)30T细胞(bāo)分化。虽(suī)然本文的结果表明(míng)m6A甲基化促进子宫内膜(mó)肿瘤发生,其他癌症也与METTL 3高(gāo)表达和m6A甲基化(huà)增加有关,也可能涉及(jí)不同的机(jī)制。然而,我们(men)的(de)结果(guǒ)表明(míng),通过m6A甲基化调(diào)节(jiē)AKT的活性,可能是一种影响一系列其他生物过程的一般生长控制机制,这(zhè)将是未来探索(suǒ)的一个新(xīn)方(fāng)向。
6Molecular Cell:Zc3h13调节核(hé)RNA m6A甲基化和(hé)小鼠胚(pēi)胎干细胞自我更新

基因表(biǎo)达调(diào)控是生命(mìng)活(huó)动的核心(xīn)事件(jiàn)之一。RNA化学修饰是基因表达(dá)调控的重要手段。RNA m6A修饰(shì)广泛存在于病毒、细菌、单细胞生物和酵母(mǔ)等多个物种中(zhōng),是真核生物mRNA上发生最为广泛(fàn)的内部化学修饰。
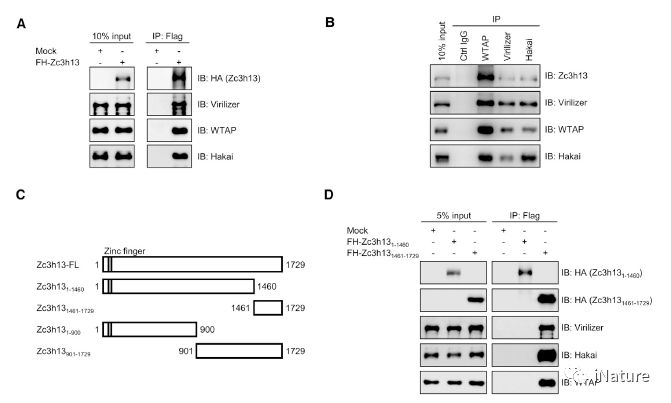
Zc3h13与WTAP,Virilizer和Hakai互作
RNA m6A修饰参与调(diào)节mRNA稳定性、剪接加(jiā)工(gōng)、转运以及翻译等一系(xì)列mRNA加工代谢过程,对mRNA的命运决定发挥重(chóng)要(yào)作用。越(yuè)来越多的科学证据显示mRNA m6A修饰在细胞分(fèn)化、生(shēng)物个体发育及(jí)癌症疾病发生(shēng)等一系(xì)列生命过程中具有重要作用,成为(wéi)近年(nián)来表观转录组学的研究热(rè)点之一。
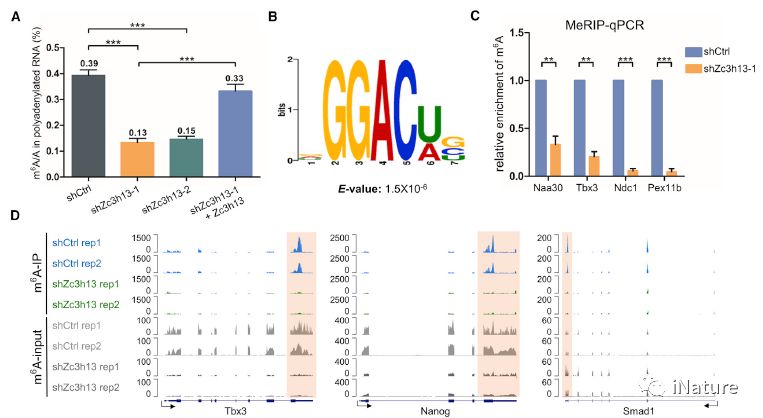
Zc3h13调节mESCs中的(de)mRNA m6A
哺乳(rǔ)动物细(xì)胞中(zhōng)约25%的mRNA有(yǒu)m6A修(xiū)饰,围绕该修饰的甲(jiǎ)基转移酶复(fù)合物(wù)、去甲基转移酶和识别蛋(dàn)白的(de)研究较多,但(dàn)是参与该修饰的调控蛋白以(yǐ)及该修饰的位点特异性调控机制依然不完全清楚。在(zài)该论文中,研究者(zhě)报道了Zc3h13是一个调控RNA m6A修(xiū)饰的新(xīn)成(chéng)员。研(yán)究发(fā)现,在小鼠胚胎(tāi)干(gàn)细胞(bāo)中抑制Zc3h13表达导致mRNA m6A水平显著降低,且这些下降(jiàng)的m6A主要(yào)发生(shēng)在mRNA的3’端非(fēi)编(biān)码区域。
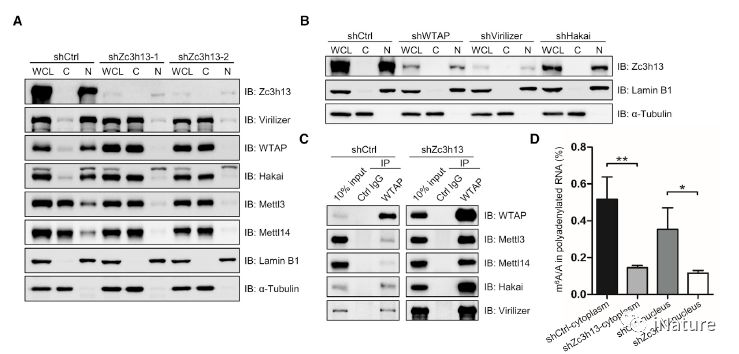
Zc3h13控制WTAP,Virilizer和Hakai的核定位
此前,有报道显示Zc3h13存在于(yú)一个进化(huà)上保守的复(fù)合物Zc3h13-WTAP-Virilizer-Hakai之中。研究者在(zài)探讨Zc3h13对m6A调(diào)控的分子机制研究中发现Zc3h13对m6A的调节是通(tōng)过控制复合物成员WTAP/Virilizer/Hakai的细胞定位而发生(shēng)作用的。抑(yì)制Zc3h13表(biǎo)达导致复合(hé)物成(chéng)员WTAP、Virilizer及Hakai蛋白发生由细胞(bāo)核向细胞质的转移,同时(shí)伴随甲基(jī)转移酶Mettl3和Mettl14蛋(dàn)白核内组分的减少,从(cóng)而抑(yì)制(zhì)m6A的形成。
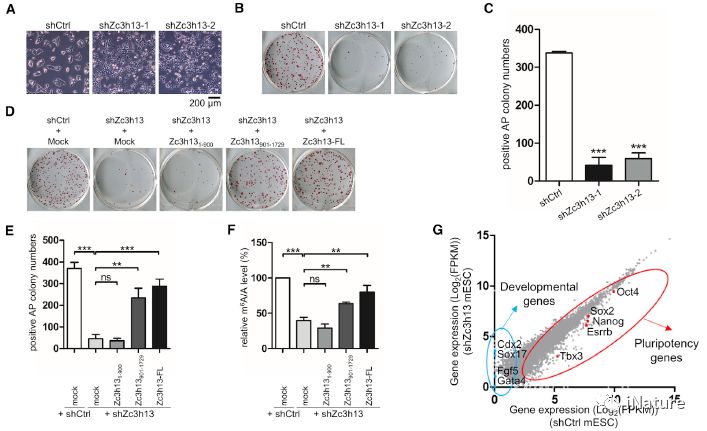
Zc3h13丧失损害mESC自我更新
有(yǒu)意思的是(shì),在细胞中敲(qiāo)低(dī)WTAP、Virilizer和Hakai,Zc3h13的核(hé)内定位并不受影响,这提示(shì)了Zc3h13在(zài)该复(fù)合物(wù)的细胞定位(wèi)中具有(yǒu)独特的作用;同时,也为揭示m6A 修饰的特异调控机制提供了线索。此(cǐ)外,研究者还(hái)发现敲低Zc3h13会损害小鼠胚胎干细(xì)胞的自我更(gèng)新潜能并促进细(xì)胞(bāo)的分化,为m6A途径调节(jiē)小鼠胚胎干(gàn)细(xì)胞(bāo)的多潜能性(xìng)提供了进一步的证据和线索。
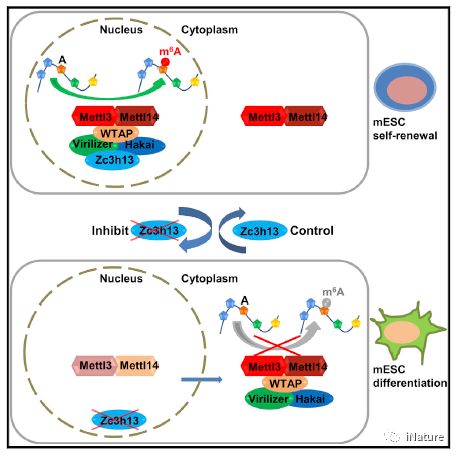
文章模型
复旦大学刁建(jiàn)波副研究员(yuán)、施扬教授、石雨江教授和芝加(jiā)哥大学何川教授为论文的共同(tóng)通讯作者。复(fù)旦(dàn)大(dà)学生物医学研(yán)究(jiū)院(yuàn)博士研究生温菁、吕瑞途和博士后马红辉(huī)为论(lùn)文的共同第一作者。
7Cell Research:5-羟(qiǎng)甲基胞嘧啶(dìng)在循环无细胞DNA中(zhōng)的特征是人类癌(ái)症的诊断生物标志物

DNA修饰(shì)如(rú)5-甲基胞嘧啶(5mC)和(hé)5-羟(qiǎng)甲(jiǎ)基胞嘧啶(5hmC)是已知影响(xiǎng)哺乳动物基因(yīn)表达的表观遗传学标记。鉴于(yú)它们在人类基因组中的(de)广泛分布特性,与基(jī)因表达密切相关和高度的化学稳定性(xìng),这(zhè)些DNA表观遗传(chuán)标记可以作为癌症诊断的理(lǐ)想(xiǎng)生物标志物。利用高度敏感和选(xuǎn)择(zé)性的(de)化学标记(jì)技术,何川等人在这里收集了最近诊断患有(yǒu)结直肠癌(ái),胃癌,胰腺癌,肝(gān)癌或甲(jiǎ)状腺癌的患(huàn)者和来自90个健康个体的正(zhèng)常组织样品,进行对(duì)循(xún)环无细(xì)胞DNA(cfDNA)5hmC分析。
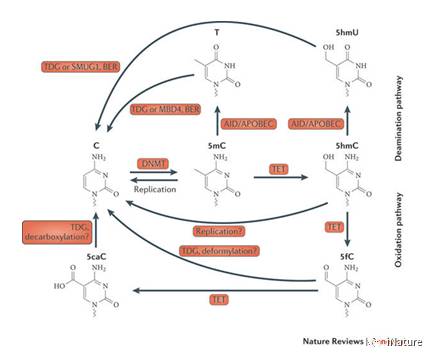
去甲基化过(guò)程
发现5hmC主要分布在(zài)转录活性区(qū)域,与(yǔ)开放的染色质和活性组蛋(dàn)白修饰(shì)相一(yī)致。在cfDNA中鉴定出可靠的癌症相关的(de)5hmC标签,这(zhè)是特定癌症(zhèng)类型(xíng)的特(tè)征。基于5hmC的循环cfDNA生物标志(zhì)物对结肠直肠癌和(hé)胃癌具有(yǒu)高度预测性,优于常规(guī)生物标志(zhì)物,与来自(zì)组织(zhī)活检的5hmC生物标志物相当。因此(cǐ),这种新的策略可以导致(zhì)从血液样本的(de)分析中发展(zhǎn)有(yǒu)效的,微创的(de)癌症(zhèng)诊断和预后(hòu)方法(fǎ)。
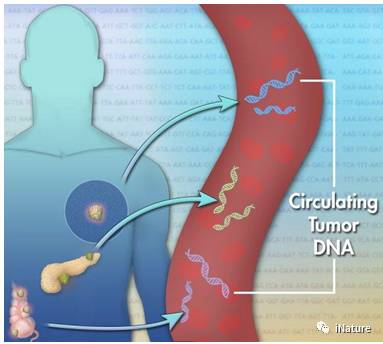
癌细胞释放DNA到(dào)血液
胞嘧啶甲基化(形成5-甲(jiǎ)基胞嘧啶,5mC)是影响基因表达的公(gōng)认的表观遗传(chuán)学修饰【1,2】。 DNA的5mC重构(gòu)在哺乳动物发育和细胞(bāo)分化以及(jí)癌症(zhèng)发生,进展和治疗反应过程中广泛使(shǐ)用【3,4】。哺乳(rǔ)动物基(jī)因(yīn)组中的活性去甲基化是由将5mC修饰氧化为5-羟甲基胞嘧啶(5hmC)【5,6】,以及进一(yī)步转(zhuǎn)化为(wéi)5-甲酰基胞嘧(mì)啶(5fC)和5-羧基胞嘧(mì)啶(5caC)的TET家族(zú)的双加氧酶完(wán)成【7,8,9】。 “中(zhōng)间”5hmC不仅(jǐn)标志着活跃的去甲基化,而且还是一个相对稳定的DNA标记(jì),具有不同的表(biǎo)观遗传角色(sè)【2,10-15】。 5hmC在(zài)各种哺乳动物细胞和组织中(zhōng)最近(jìn)的全基因组测序图谱支持其作为基因表达的标记(jì)的(de)作用(yòng)【16-21】;它在增强子,gene body和启动子富(fù)集,5hmC的(de)变化与基(jī)因表达水平的变化相关【22,23】。
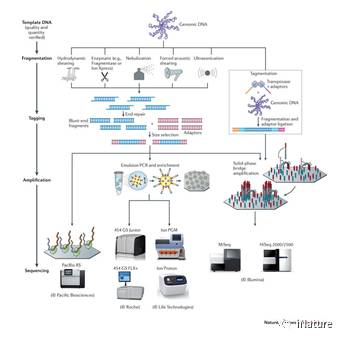
高(gāo)通量测序
来自循环血液中不同组织的无细胞DNA(cfDNA)的发现(xiàn)对临床(chuáng)具有革命(mìng)性的潜在应用【24】。基于液体活检(jiǎn)的生物标志物和检测工具与(yǔ)现有的诊断和预后方法相比具(jù)有(yǒu)显著的优势,包括微创。因此,他(tā)们具有成本(běn)效益的潜力,可(kě)以促进更高的患者依从性和临床便利(lì)性,从而实(shí)现动(dòng)态监(jiān)测【25】。

人类癌症的cfDNA中,检测5hmC的生物标志(zhì)物
肿瘤相(xiàng)关的(de)cfDNA体细(xì)胞突变(biàn)已经显示与肿瘤组织共享,尽管低的突变频(pín)率和缺乏来(lái)源(yuán)组织的信息阻(zǔ)碍(ài)了检测(cè)的敏感性。 5mC和5hmC来自液体活(huó)组织检查的cfDNA可(kě)以作为(wéi)平(píng)行(háng)或更有价值(zhí)的(de)生物标志物(wù),用于人类(lèi)疾(jí)病(bìng)的非(fēi)侵入性诊断和预(yù)后(hòu),因为它们概括了(le)相关细胞状态中的基因表达变化(huà)。如果可以灵敏地检测这些(xiē)胞嘧啶修(xiū)饰模式,则可以鉴定疾病特异性生(shēng)物标志物,用(yòng)于(yú)早期的肿瘤检测,诊断和预后。
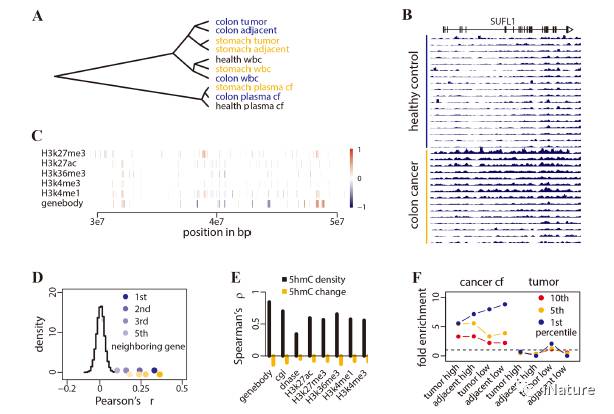
5hmC在癌细(xì)胞的差异化(huà)富(fù)集
高通(tōng)量(liàng)测序(xù)是检测全(quán)基因组(zǔ)胞嘧啶修饰(shì)模式的理想平台。全基因(yīn)组(zǔ)亚硫酸氢盐测序或替代方法已应(yīng)用(yòng)于生物标志物研究【26-28】。组织和癌症特异性(xìng)甲基化位点在跟踪来自(zì)循环血的来源组(zǔ)织中,表现出有希望的潜力。然而,5mC主要作为(wéi)人类(lèi)基因(yīn)组(zǔ)中高背景水平的抑(yì)制性(xìng)标记,并(bìng)且其用亚硫酸氢盐处理的测序一直受到广泛的DNA降解。利用羟甲基的存在(zài),选择(zé)性化学标记可(kě)应(yīng)用于使用(yòng)低(dī)水平的(de)DNA以高灵敏度检测5hmC。在这里,何川等研究组建立了5hmC临床诊断(duàn)技术,用于cfDNA 5hmC分析。显示显示(shì)cfDNA的5hmC差(chà)异富集,是实体瘤的优秀标记。
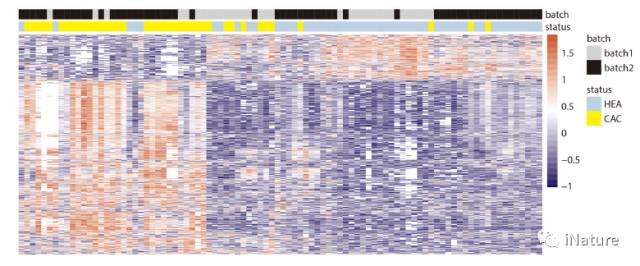
胰腺(xiàn)癌5hmC分布状况
癌症cfDNA的(de)动态在很大程度上(shàng)还不清楚。在简化的(de)模型情况下,肿(zhǒng)瘤组织的(de)gDNA被释放到血浆中并且经(jīng)历降解,达到(dào)与来自正常健康组织的背(bèi)景(jǐng)cfDNA类似的平衡(héng)。基因座特异性5hmC修饰似乎(hū)是5hmC水平的主要(yào)决(jué)定因素,具(jù)有组织特异性,然后(hòu)癌症状态增加额外的变化层。这(zhè)些组织,以及(jí)在较小的程度上肿瘤组织释(shì)放的DNA中(zhōng)的癌症特异性信号,略微改变背景血浆(jiāng)cfDNA的5hmC修饰谱。从肿瘤组织(zhī)中释放的cfDNA越多,转移越大,给区(qū)分肿瘤来源的生物学(xué)和(hé)临床变化提供(gòng)了更大的能力。因此,整合来自不同组织类型的(de)gDNA的5hmC概况,以实现对癌症生(shēng)物标志物的疾病(bìng)特异性的(de)未来评估,将(jiāng)是至关重要的。
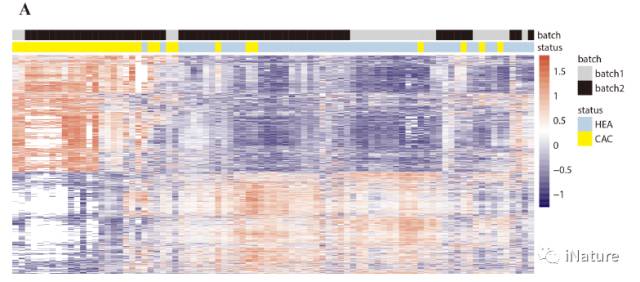
胃(wèi)癌(ái)中5hmC分布状况
此(cǐ)外,实体瘤由癌干(gàn)细胞和癌细胞组成,在由白细胞,间充(chōng)质细胞(bāo)和细胞外基质构成的微环境中。肿瘤进展启动了以缺(quē)氧和血管形(xíng)成为特征的局部环境的变(biàn)化梯度。在生长的肿瘤及其周(zhōu)围的细胞(bāo)内,可(kě)能存在(zài)广泛的(de)变异(yì)性,使得某些类(lèi)型的细(xì)胞倾(qīng)向于(yú)凋亡(wáng)并将(jiāng)DNA释(shì)放到循环中。
血(xuè)浆cfDNA中观察到癌(ái)症相(xiàng)关5hmC变化(huà)的起源
何(hé)川等研(yán)究组预计(jì)在血浆cfDNA中观察(chá)到的5hmC的癌症相(xiàng)关变化是(shì)由肿瘤组织(zhī)内或周(zhōu)围的(de)不同组(zǔ)细胞贡献(xiàn)的。肿瘤相关(guān)组织(zhī)的单细(xì)胞或(huò)细胞类型特异性5hmC分析和使用适当的细胞类(lèi)型标记物,将揭示这(zhè)些修(xiū)饰的细胞特异(yì)性的程度和分布,并进一步阐明(míng)有助于(yú)在血浆cfDNA中观察到癌(ái)症相(xiàng)关的5hmC变化。这是这(zhè)个学科所要达到(dào)的意图(tú),同时也是未来的发展方向。
合肥hth和中科金臻生物医学有限(xiàn)公(gōng)司 版权(quán)所(suǒ)有 皖ICP备(bèi)16021320号-1 Designed by Wanhu